Khám phá sự đa dạng trong bệnh ung thư phổi: Tác động đến tỷ lệ mắc bệnh, tiên lượng và chiến lược điều trị
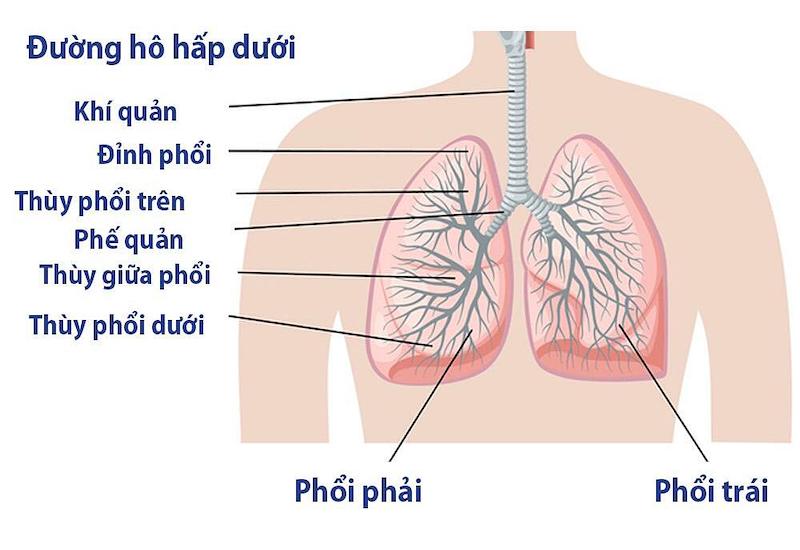
Ung thư phổi là căn bệnh ung thư chết người phổ biến nhất với 1,6 triệu ca mắc mỗi năm. Sự đa dạng của nhiều loại ảnh hưởng đến tỷ lệ mắc bệnh, quá trình và kết quả của bệnh ung thư phổi. Về mặt hình thái, ung thư phổi có bốn loại khác nhau – tế bào vảy, tế bào nhỏ, tế bào lớn và ung thư biểu mô tuyến.
sự đa dạng trong bệnh ung thư phổi
Lý lịch
Các khối u tế bào vảy và tế bào nhỏ của phổi chiếm khoảng 1/3 và 1/5 (tương ứng 30% và 18%) ung thư phổi, cả hai đều phát sinh từ biểu mô đường thở. Ung thư biểu mô tuyến chiếm 30% khác và bắt nguồn từ biểu mô đường thở nhỏ. 10% còn lại là các khối u tế bào lớn, chủ yếu ở vị trí ngoại vi.
Ung thư tế bào nhỏ ban đầu đáp ứng tốt với hóa trị liệu, nhưng thường tái phát. Các đợt tái phát có khả năng kháng hóa trị và lây lan toàn thân, dẫn đến cái chết của bệnh nhân.
Ngược lại, ung thư phổi không phải tế bào nhỏ không thể đoán trước trong phân loại chẩn đoán và tiên lượng. Do đó, ngay cả khi khối u nguyên phát được cắt bỏ thành công, ung thư di căn vẫn dẫn đến tử vong ở một nửa số bệnh nhân.
Nhiều nghiên cứu đã chỉ ra rằng sự đa dạng ở mức độ biểu hiện gen, biểu sinh và gen có liên quan đến khả năng sống sót kém đối với các khối u phổi không phải tế bào nhỏ.
Đa dạng phiên mã RAS
Các gen gây ung thư thuộc họ RAS xuất hiện ở 1/5 tổng số khối u ở người, thúc đẩy quá trình hình thành khối u và sự tiến triển của khối u. Một loại được gọi là đột biến KRAS đã được xác định là tác nhân kích hoạt bệnh ở một phần ba ung thư biểu mô tuyến phổi. Tuy nhiên, có sự đa dạng trong sự đóng góp của KRAS vào tiên lượng ung thư phổi.
Điều này có thể là do các con đường RAS được điều chỉnh nhiều bởi các yếu tố khác. Sự khác biệt này được làm nổi bật bởi sự xuất hiện của hoạt hóa gen gây ung thư RAS ở 84% ung thư biểu mô tuyến phổi, mặc dù 65% sở hữu gen KRAS kiểu hoang dã.
Hoạt động RAS cao có liên quan đến phản ứng kém với hóa trị liệu và kết quả xấu. RAS84 là một chữ ký phiên mã tương quan chặt chẽ với hoạt động gây ung thư RAS.
Do đó, một số nhà khoa học cho rằng “ RAS84 nắm bắt hoạt động gây ung thư của RAS trong các mẫu khối u tốt hơn so với trạng thái đột biến của KRAS ” và có thể giúp phân tầng bệnh nhân về khả năng sống sót, tiến triển ung thư và khả năng kháng trị.
đa dạng vô tính
Các khối u bắt đầu với một tế bào ung thư duy nhất, nhưng với sự tăng sinh tế bào khối u, sự đa dạng dòng vô tính bắt đầu tự biểu hiện. Đó là, các khối u thường chứa các nhóm tế bào ung thư khác nhau thể hiện các phản ứng khác nhau đối với cùng một phương pháp điều trị.
Sự đa dạng dòng vô tính này đã được đưa ra ánh sáng thông qua công nghệ giải trình tự tế bào đơn. Với sự xuất hiện của các liệu pháp nhắm mục tiêu và y học cá nhân hóa, điều cần thiết là phải hiểu được sự đa dạng trong khối u, bởi vì những liệu pháp này tác động lên các tế bào có chứa các đột biến cụ thể. Do đó, các tế bào khối u khác thiếu các yếu tố di truyền này sẽ sống sót sau liệu pháp và cuối cùng gây tái phát.
Tiến sĩ Koichi Takahashi, bác sĩ và nhà nghiên cứu cho biết : “ Có lẽ trong tương lai, chúng ta có thể thiết kế các kết hợp trị liệu tốt hơn để ngăn chặn những dòng con đó sống sót và gây tái phát .
Sử dụng các kỹ thuật giải trình tự RNA đơn bào, các nhà khoa học đã chỉ ra rằng hóa trị liệu thường khiến các tế bào được điều trị chuyển sang trạng thái ngủ đông bằng cách sử dụng các gen sửa chữa và làm hỏng. Điều này cho phép họ sống sót sau liệu pháp độc hại.
Những tế bào này cho thấy một dấu hiệu khác, cho thấy sự tái tạo tế bào phế nang, so với các tế bào tồn tại và sinh sôi nảy nở ngay cả trong quá trình trị liệu. Loại thứ hai cũng ngăn chặn phản ứng miễn dịch của vật chủ trong môi trường vi mô khối u, trong khi loại thứ nhất thể hiện trạng thái viêm nhiễm, bị xâm nhập bởi các tế bào T hoạt động .
Tuy nhiên, con đường ngủ đông cung cấp một mục tiêu điều trị tiềm năng thông qua tầng tín hiệu WNT/-catenin được kích hoạt bởi các tín hiệu sinh tồn và tổn thương tế bào. Ngược lại, con đường kynurenine được điều chỉnh đặc trưng trong bệnh tiến triển trong khi điều trị, điều này cũng có thể đưa ra một điểm có thể nhắm mục tiêu khác, mặc dù trong một thời gian ngắn.
Nhà nghiên cứu Trevor Bivona cho biết: “ Đặt tính không đồng nhất của khối u lên hàng đầu và làm trung tâm sẽ trang bị tốt hơn cho các bác sĩ lâm sàng thông tin cho phép có được cửa sổ có độ phân giải cao về sự tiến triển của khối u trong quá trình điều trị và giúp chúng tôi sử dụng lộ trình như vậy để can thiệp chủ động hơn nhằm kiểm soát khối u tốt hơn và giúp đỡ bệnh nhân .”
Ngay cả khi ngược lại, nghiên cứu chỉ ra rằng số lượng subclone được đặc trưng bởi các đột biến khác nhau là một yếu tố tiên lượng quan trọng hơn so với danh tính của từng subclone, trong một số khối u mặc dù không phải tất cả. Đây có thể là kết quả của sự mất ổn định bộ gen cao hơn, do đó có thể thúc đẩy tỷ lệ biến đổi ác tính.
Tuy nhiên, điều này bị phản đối bởi một hiện tượng gọi là quét vô tính, trong đó các dòng vô tính thích nghi cao được sinh ra khi các đột biến của chúng tăng tần số để trở nên cố định. Điều này làm giảm sự biến đổi di truyền trong các chuỗi di truyền gần đó.
Những lần quét như vậy có thể làm giảm sự đa dạng của dòng vô tính trong các khối u xâm lấn, mặc dù tần số quét được điều biến bằng sự can thiệp của dòng vô tính.
Công việc tiếp theo là cần thiết để hiểu làm thế nào đa dạng di truyền tương tác với các dấu hiệu tiên lượng thông thường hơn như cấp độ khối u và giai đoạn. Ai cũng biết rằng tốc độ phân chia tế bào trung bình là một dấu hiệu tương đối đáng tin cậy về sự phát triển của khối u trong tương lai, bởi vì nó tương quan với cấp độ khối u.
Hạn chế của đa dạng dòng vô tính
Tuy nhiên, việc sử dụng tính đa dạng dòng vô tính như một dấu hiệu tiên lượng là không đáng tin cậy do không thể đoán trước được sự tiến triển của khối u giữa các bệnh nhân trong một đoàn hệ hoặc do mức độ biến đổi thấp giữa các bệnh nhân.
Nhưng câu chuyện liên quan
Sự mở rộng của bản sao cũng bị hạn chế bởi sự tương tác của nó với các bản sao khác gần đó và bởi sự gần gũi của nó với rìa khối u. Do đó, sức mạnh và tính hữu ích của mối tương quan giữa tính đa dạng và sự phát triển của khối u phụ thuộc vào giai đoạn đo lường tính đa dạng.
Khi được đo ở các khối u ban đầu, sự đa dạng của dòng vô tính có liên quan tích cực với tốc độ phát triển tiếp theo của khối u, nhưng tiêu cực khi được đo ở các giai đoạn sau. Một lần nữa, tất cả các dòng vô tính không đóng góp như nhau vào sự phát triển của khối u.
Những tế bào phù hợp và lan nhanh ra ngoài rìa tiến triển, hoặc những tế bào phát sinh gần rìa, có nhiều khả năng thúc đẩy sự phát triển của khối u hơn so với những tế bào nằm trong lõi khối u.
Hơn nữa, khi được đánh giá ở kích thước khối u trung bình, sự đa dạng của dòng vô tính chỉ tương quan với sự phát triển của khối u với tốc độ luân chuyển dòng vô tính thấp. Điều này là do tỷ lệ đột biến trình điều khiển thấp, thể lực của trình điều khiển giảm và khả năng chuyên chở nhỏ.
Sự đa dạng vô tính cũng cung cấp cái nhìn sâu sắc về sự tiến hóa của bệnh ung thư. Ví dụ, Chữ ký vũ trụ phiên mã 4, có liên quan chặt chẽ với việc hút thuốc, chiếm ưu thế trong các đột biến thân, cho thấy ảnh hưởng mạnh mẽ của việc hút thuốc đối với các đột biến ban đầu gây ra nhiều bệnh ung thư phổi.
Ngược lại, nó giảm đi nhiều trong các đột biến không phải thân cây, trong đó Chữ ký Vũ trụ 3, liên quan đến các khiếm khuyết sửa chữa đứt gãy DNA sợi kép, chiếm phần lớn nhất.
đa dạng miễn dịch
Một loại đa dạng khác có liên quan đến mức độ thâm nhiễm miễn dịch, khác nhau giữa các khối u phổi tế bào nhỏ (thâm nhiễm tế bào T thấp hơn) và tế bào không nhỏ (thâm nhiễm cao hơn). Các khối u tế bào không nhỏ cho thấy mất khả năng dị hợp tử (LOH), hoặc đột biến soma, dẫn đến sự trốn thoát miễn dịch hoặc kháng lại liệu pháp phong tỏa điểm kiểm soát miễn dịch (ICB).
Phản ứng tế bào T gây độc tế bào CD8+ nhắm mục tiêu HLA-1 là chìa khóa cho chức năng ICB. Tuy nhiên, các tế bào T CD4+ gây độc tế bào có thể thúc đẩy hoạt động chống khối u nhắm vào các tế bào ung thư phổi không phải tế bào nhỏ mang HLA-II. Bằng cách này, mặc dù tế bào T CD8+ trốn tránh, phản ứng CD4+ có thể thúc đẩy phản ứng ICB. Điều này có thể giải thích tại sao một số khối u như vậy có tiên lượng tốt hơn mặc dù gánh nặng đột biến khối u cao hơn.
Hồ sơ biểu hiện gen đa dạng
Các khối u phổi có hình thái không đồng nhất và các chẩn đoán dựa trên sinh thiết ban đầu được biết là thay đổi sau khi kiểm tra mô được loại bỏ trong quá trình phẫu thuật xác định. Các khối u hỗn hợp cũng được biết đến, chẳng hạn như các khối u tế bào nhỏ-không phải tế bào nhỏ kết hợp hoặc ung thư biểu mô tuyến vảy.
Các mẫu biểu hiện gen đã được sử dụng để phân loại ung thư phổi trong bốn loại tiêu chuẩn thành các nhóm nhỏ cho thấy các mức độ khác nhau và có tiên lượng khác nhau. Điều này giúp xác định sự biệt hóa và hành vi của tế bào khối u.
Ví dụ, hồ sơ biểu hiện gen trong ung thư biểu mô tuyến tương tự về hình thái có thể dự đoán thành công cấp độ khối u và giai đoạn lâm sàng, và do đó cơ hội sống sót, trong các khối u biệt hóa tốt và biệt hóa kém. Hơn nữa, nó có thể xác định một tập hợp con thứ ba với sự khác biệt kém nhưng tỷ lệ sống sót tốt.
Các dấu hiệu gen như vậy có thể giúp chuẩn hóa phân loại khối u hình thái, hiện tại nhất thiết bị ảnh hưởng bởi sự biến đổi của máy chủ và thường là một hướng dẫn điều trị dưới mức tối ưu.
Đa dạng săc tộc
Nghiên cứu gần đây cho thấy sự khác biệt đáng kể về sắc tộc giữa bệnh ung thư phổi (ung thư biểu mô tuyến và ung thư biểu mô vảy) ở bệnh nhân châu Á và phương Tây. Hai đột biến phổ biến nhất trong ung thư phổi không phải tế bào nhỏ ảnh hưởng đến thụ thể yếu tố tăng trưởng biểu bì (EGFR) và locus anaplastic lymphoma kinase (ALK).
Trong một nghiên cứu từ Trung Quốc, tỷ lệ đột biến dòng mầm P/LP ở bệnh ung thư Trung Quốc cao hơn so với ung thư phương Tây. Một lần nữa, một số gen là duy nhất đối với bệnh ung thư Trung Quốc và một số gen khác đối với bệnh ung thư phương Tây.
Thứ hai, chỉ có khoảng một phần ba đột biến dòng mầm được thấy trong các khối u phương Tây xuất hiện ở bệnh nhân Trung Quốc, và thậm chí như vậy, tỷ lệ đột biến soma khác nhau ở những người có đột biến dòng mầm khác với những người không có. Các đột biến dòng mầm BRCA2 và đột biến soma EGFR cũng phổ biến hơn ở bệnh ung thư châu Á. Tuy nhiên, đột biến dòng mầm EGFR ít phổ biến hơn ở bệnh nhân Trung Quốc có đột biến soma EGFR so với bệnh nhân phương Tây.
Những khác biệt về bộ gen này có thể là do cả yếu tố dân tộc và phơi nhiễm, thay đổi theo quần thể di truyền và vị trí địa lý. Suy luận rõ ràng là các nghiên cứu và thử nghiệm lâm sàng nên bao gồm một loạt các nguồn gốc dân tộc và chủng tộc để đảm bảo tính khái quát.
Ở Hoa Kỳ, Người da đen chiếm khoảng 1/7 tổng số bệnh nhân ung thư phổi , nhưng chỉ có 3% số người tham gia thử nghiệm lâm sàng. Để giúp giải quyết vấn đề này, Hiệp hội Phổi Hoa Kỳ đã triển khai chiến dịch “Nhận thức, Tin tưởng và Hành động” vào tháng 1 năm 2022. Wendy Short Bartie, một trong những quan chức của công ty tài trợ, cho biết: “ Giáo dục là một thành phần thiết yếu để cải thiện tính đa dạng trong thử nghiệm lâm sàng ghi danh để đảm bảo rằng tất cả những người bị ảnh hưởng bởi bệnh ung thư đều có thể hưởng lợi như nhau từ khoa học và phương pháp điều trị mới nhất .”
Phần kết luận
Sự chênh lệch về địa lý về nguồn lực kinh tế xã hội, chi phí của các liệu pháp nhắm mục tiêu và chẩn đoán phân tử cũng như sự khác biệt trong các phương pháp xét nghiệm được sử dụng chiếm phần lớn sự khác biệt về kết quả giữa các quần thể và khu vực khác nhau. Lập bản đồ gen hợp tác chi tiết và quản lý chi phí trải dài khắp các châu lục sẽ rất cần thiết để xác định và khai thác các locus liên quan đến ung thư.
“ Người ta dự đoán rằng việc mở rộng kiến thức về bộ gen soma và di truyền sẽ nâng cao hơn nữa sự hiểu biết của chúng ta về di truyền ung thư và dẫn đến các chiến lược cải tiến để phòng ngừa, phát hiện và điều trị ung thư. ” Chiến lược sàng lọc một số bệnh ung thư có thể thay đổi đáng kể với kiến thức như vậy.